Tóm tắt
Curcumin, một hợp chất polyphenol tự nhiên, sở hữu nhiều hoạt tính dược lý tiềm năng nhưng bị hạn chế nghiêm trọng bởi sinh khả dụng đường uống thấp do độ tan trong nước kém và chuyển hóa nhanh. Báo cáo này phân tích sự tiến hóa của các hệ thống dẫn truyền thuốc (DDS) ứng dụng công nghệ nano để khắc phục những rào cản này. Chúng tôi tập trung vào cơ sở vật lý, đặc biệt là định luật Noyes-Whitney, để giải thích cơ chế tăng cường độ hòa tan thông qua việc giảm kích thước hạt. Ba hệ thống nano-DDS chính—liposome, tiểu phân nano polyme, và micelle—được phân tích sâu về cấu trúc, ưu nhược điểm và ứng dụng. Báo cáo khẳng định rằng công nghệ nano không chỉ cải thiện các thông số dược động học mà còn mở ra hướng đi mới cho việc điều trị đích, biến curcumin từ một hợp chất tiềm năng thành một tác nhân trị liệu hiệu quả.
1. Giới thiệu : Khái niệm truyền dẫn thuốc ( DDS)
Hệ thống dẫn truyền thuốc (Drug Delivery System – DDS) là một lĩnh vực khoa học bào chế tập trung vào việc thiết kế các công nghệ, công thức hoặc hệ thống để vận chuyển một hợp chất dược phẩm trong cơ thể nhằm đạt được hiệu quả điều trị một cách an toàn và có kiểm soát. Mục tiêu của một DDS lý tưởng là tối ưu hóa dược động học (pharmacokinetics) và dược lực học (pharmacodynamics) của thuốc, bao gồm việc tăng cường độ tan, cải thiện sinh khả dụng, kéo dài thời gian tuần hoàn, và hướng thuốc đến đúng mô hoặc tế bào đích (Salehi et al., 2024).
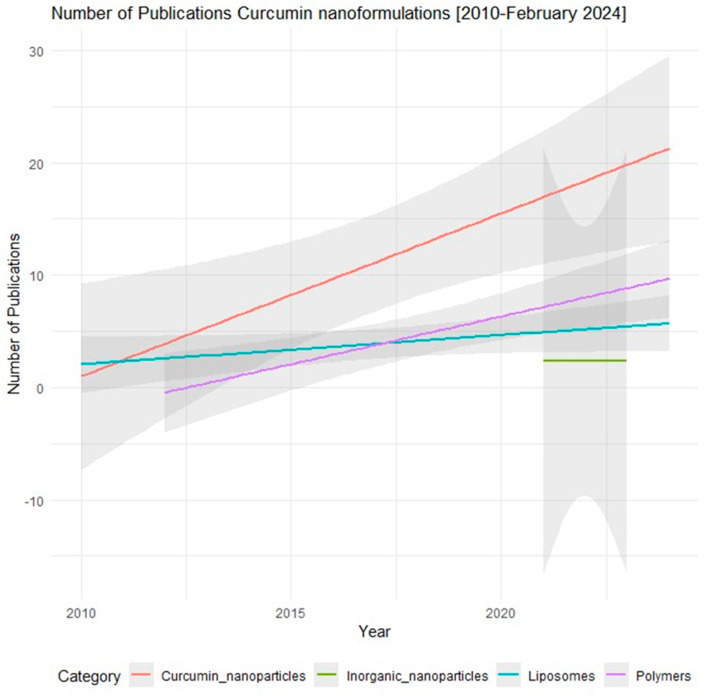
Trong bối cảnh đó, curcumin, thành phần hoạt chất chính trong củ nghệ (Curcuma longa), đã thu hút sự quan tâm lớn của giới khoa học nhờ phổ hoạt tính sinh học rộng, bao gồm chống viêm, chống oxy hóa, và phòng ngừa ung thư (Anand et al., 2011). Tuy nhiên, tiềm năng trị liệu của curcumin ở dạng tự do bị cản trở đáng kể bởi các đặc tính dược động học không thuận lợi. Curcumin là một phân tử thân dầu (lipophilic), hầu như không tan trong nước, dẫn đến khả năng hấp thu qua đường tiêu hóa rất kém. Hơn nữa, nó trải qua quá trình chuyển hóa và thải trừ nhanh chóng ở gan và thành ruột, khiến nồng độ trong huyết tương và tại mô đích không đủ để phát huy tác dụng (Rahimi et al., 2020; Gera et al., 2014).
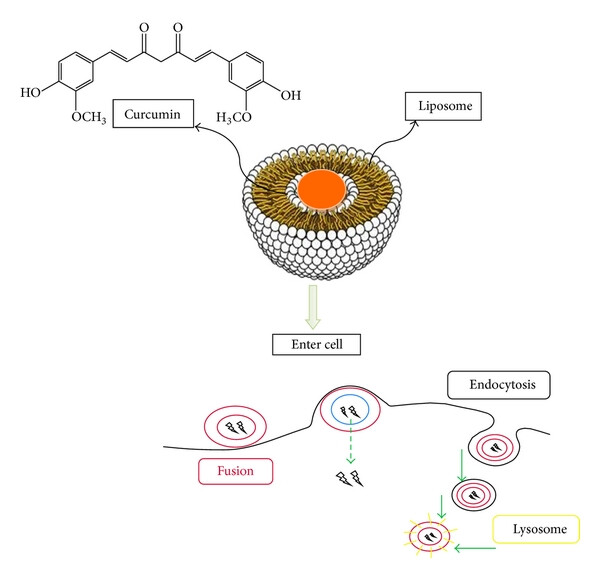
Để giải quyết những thách thức này, công nghệ nano đã nổi lên như một cuộc cách mạng trong ngành dược phẩm. Bằng cách bào chế curcumin thành các tiểu phân có kích thước nanomet (thường từ 1-100 nm), các nhà khoa học có thể thay đổi hoàn toàn các đặc tính vật lý và sinh học của nó. Các hệ thống nano curcumin (Nano Curcumin) ra đời với mục đích bảo vệ hoạt chất khỏi sự phân hủy, tăng cường độ tan và tính thấm, từ đó cải thiện đáng kể sinh khả dụng và hiệu quả điều trị (Singh et al., 2024). Báo cáo này sẽ đi sâu phân tích nền tảng khoa học và các loại hình DDS công nghệ nano tiêu biểu đã biến đổi curcumin từ một hợp chất tự nhiên thành một công cụ trị liệu tiên tiến.
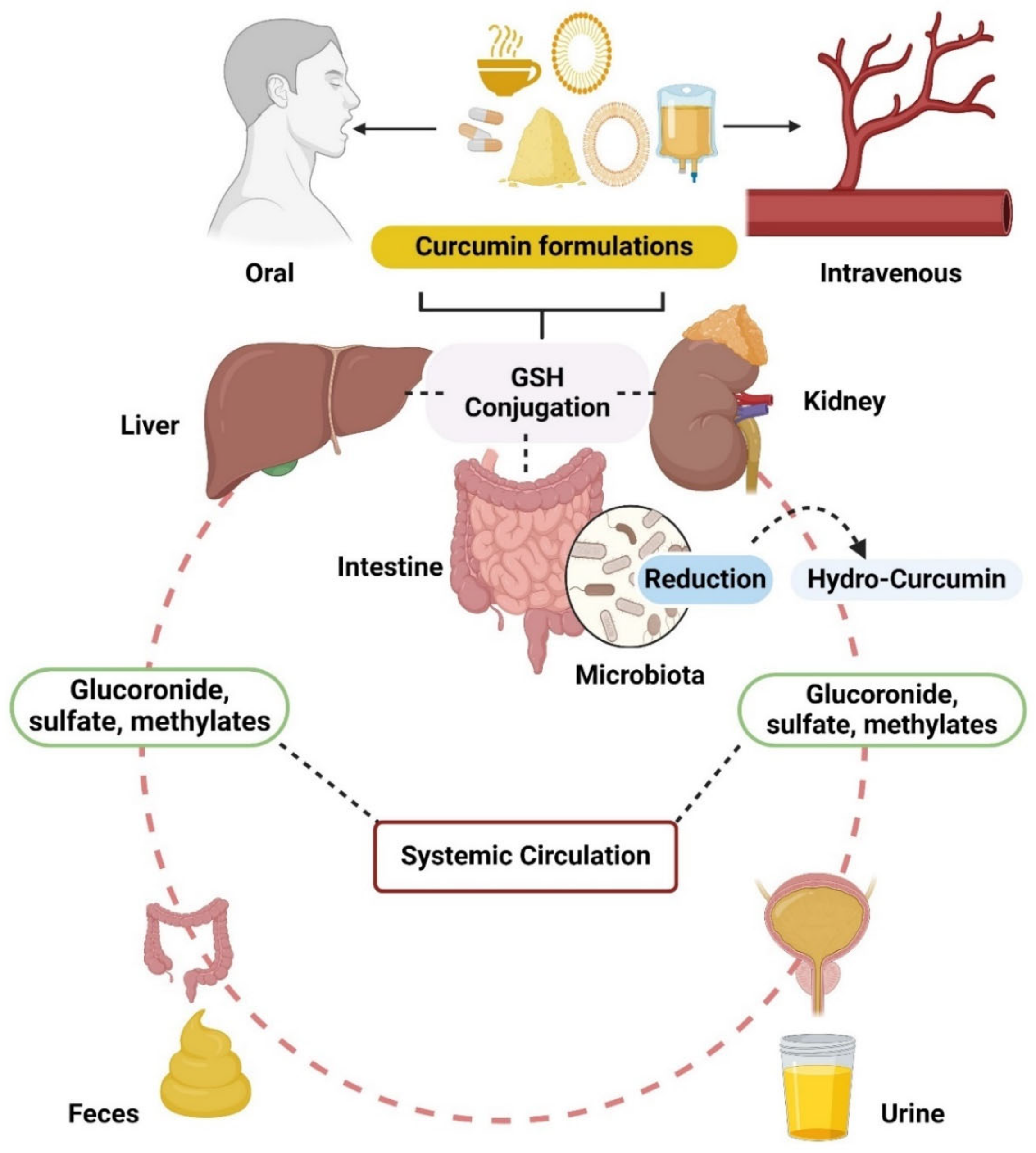
2. Physics of Nano: Nền tảng Vật lý của Công nghệ Nano
Hiệu quả vượt trội của các hệ thống nano curcumin bắt nguồn từ những nguyên lý vật lý cơ bản, đặc biệt là mối quan hệ giữa kích thước tiểu phân, diện tích bề mặt và tốc độ hòa tan. Việc giảm kích thước của một chất rắn xuống thang đo nanomet không chỉ là một sự thay đổi về quy mô mà còn làm thay đổi các đặc tính cơ bản của vật liệu.
2.1. Định luật Noyes-Whitney và Tốc độ Hòa tan
Tốc độ hòa tan của một chất rắn trong một chất lỏng được mô tả bởi phương trình Noyes-Whitney, một công thức nền tảng trong dược học và hóa lý. Phương trình này cung cấp một khuôn khổ toán học để hiểu tại sao việc giảm kích thước hạt lại là một chiến lược hiệu quả để tăng cường sự hấp thu của các loại thuốc khó tan như curcumin (Gera et al., 2014).
$$ \frac{dC}{dt} = \frac{D \cdot A}{h \cdot V}(C_s – C_t) $$
Trong đó, các biến số được giải thích như sau:
- dC/dt: Tốc độ hòa tan (sự thay đổi nồng độ theo thời gian). Đây là yếu tố quyết định tốc độ thuốc đi vào dung dịch và sẵn sàng để hấp thu.
- D: Hệ số khuếch tán của chất tan trong dung môi.
- A: Tổng diện tích bề mặt của các tiểu phân rắn tiếp xúc với dung môi. Đây là biến số quan trọng nhất bị tác động bởi công nghệ nano.
- Cs: Nồng độ bão hòa của chất tan (độ tan của chất đó trong dung môi).
- C: Nồng độ của chất tan trong dung dịch tại thời điểm t.
- h: Độ dày của lớp khuếch tán tĩnh bao quanh tiểu phân.
- V: Thể tích của dung môi.
2.2. Mối quan hệ giữa Kích thước hạt và Diện tích bề mặt
Từ phương trình Noyes-Whitney, ta thấy rằng tốc độ hòa tan (dC/dt) tỷ lệ thuận trực tiếp với diện tích bề mặt (A). Đây chính là chìa khóa của công nghệ nano. Khi một khối vật liệu được chia thành các tiểu phân nhỏ hơn, tổng thể tích không đổi nhưng tổng diện tích bề mặt tăng lên theo cấp số nhân. Ví dụ, một khối lập phương 1 cm³ có diện tích bề mặt là 6 cm². Nếu chia nó thành các khối lập phương 1 nm³, tổng diện tích bề mặt sẽ tăng lên 6,000 m² – một sự gia tăng hàng tỷ lần.
Đối với curcumin, việc giảm kích thước hạt từ micromet xuống nanomet làm tăng đột biến diện tích bề mặt tiếp xúc với dịch tiêu hóa. Theo định luật Noyes-Whitney, sự gia tăng của biến số A này dẫn đến tốc độ hòa tan (dC/dt) cao hơn đáng kể. Kết quả là curcumin được hòa tan nhanh hơn và hoàn toàn hơn trong đường ruột, tạo ra một gradient nồng độ lớn hơn qua màng tế bào, từ đó tăng cường sự hấp thu vào máu (Rahimi et al., 2020; Singh et al., 2024). Đây là cơ chế vật lý cốt lõi giải thích tại sao nano curcumin có sinh khả dụng cao hơn nhiều so với curcumin thông thường.
3. Classification: Phân loại các Hệ thống Dẫn truyền Nano Curcumin
Dựa trên vật liệu và cấu trúc, các hệ thống dẫn truyền nano curcumin có thể được phân loại thành nhiều nhóm khác nhau. Mỗi hệ thống có những đặc điểm, ưu và nhược điểm riêng, phù hợp với các mục tiêu điều trị cụ thể. Dưới đây là phân tích sâu về ba loại hình phổ biến và hiệu quả nhất.
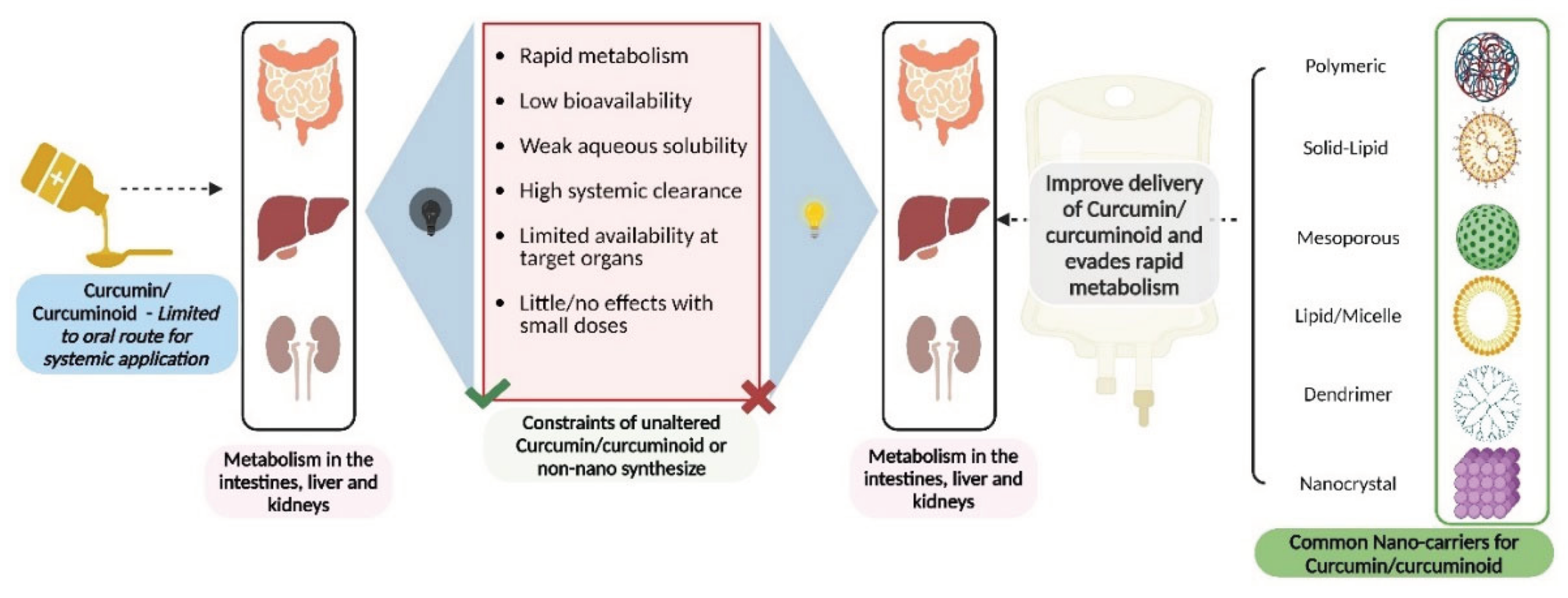
3.1. Hệ tiểu phân nano Polyme (Polymeric Nanoparticles)
Tiểu phân nano polyme là các hạt rắn có kích thước nano được tạo thành từ các polyme tự nhiên hoặc tổng hợp, có khả năng phân hủy sinh học và tương thích sinh học. Curcumin, một phân tử kỵ nước, được bao gói (encapsulated) hoặc hấp phụ (adsorbed) vào trong hoặc trên bề mặt của các tiểu phân này (Ali et al., 2024). Các polyme thường được sử dụng bao gồm poly(lactic-co-glycolic acid) (PLGA), polylactic acid (PLA), và chitosan.
Cơ chế hoạt động của hệ thống này là bảo vệ curcumin khỏi môi trường khắc nghiệt của đường tiêu hóa và sự chuyển hóa nhanh ở gan. Sau khi vào cơ thể, các tiểu phân polyme sẽ từ từ phân hủy, giải phóng curcumin một cách có kiểm soát (controlled release). Điều này không chỉ giúp duy trì nồng độ thuốc ổn định trong máu trong thời gian dài mà còn có thể giảm thiểu các tác dụng phụ (Khan, M. A., et al., 2024). Hơn nữa, bề mặt của các tiểu phân nano polyme có thể được biến tính bằng cách gắn các phối tử (ligands) đặc hiệu để hướng chúng đến các tế bào ung thư hoặc mô bị viêm, một chiến lược được gọi là “điều trị đích” (targeted therapy) (Wang et al., 2024).
3.2. Liposome
Liposome là các túi hình cầu siêu nhỏ được cấu tạo từ một hoặc nhiều lớp màng kép phospholipid, tương tự như cấu trúc của màng tế bào. Cấu trúc lưỡng tính này cho phép liposome có thể mang cả thuốc tan trong nước (ở lõi nước bên trong) và thuốc tan trong dầu như curcumin (nằm xen kẽ trong lớp màng phospholipid) (Salehi et al., 2024).
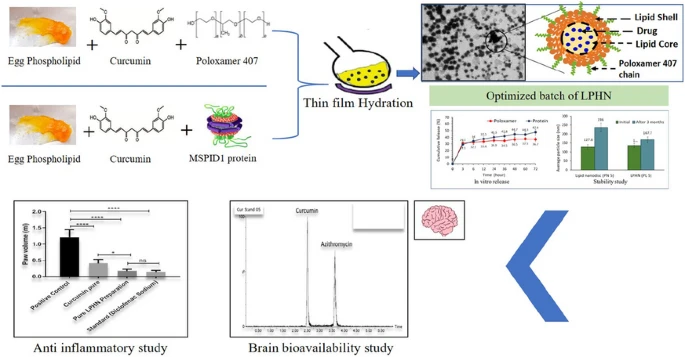
Ưu điểm chính của liposome là tính tương thích sinh học cao và khả năng dung hợp với màng tế bào để giải phóng thuốc trực tiếp vào bên trong. Việc bao gói curcumin trong liposome giúp cải thiện đáng kể độ tan và sự ổn định của nó. Để tăng thời gian tuần hoàn trong máu và tránh bị hệ thống miễn dịch nhận diện, các liposome thường được “ngụy trang” bằng cách phủ một lớp polyethylene glycol (PEG) trên bề mặt, tạo ra các “stealth liposome” (Anand et al., 2011). Các nghiên cứu gần đây còn khám phá việc sử dụng các peptide mô phỏng như MSP1D1 để tạo ra các hệ thống nano dựa trên phospholipid, cho thấy tiềm năng lớn trong việc cải thiện khả năng tải và giải phóng curcumin (Kumar et al., 2024).
3.3. Micelle
Micelle là các cấu trúc nano tự lắp ráp (self-assembled) được hình thành trong dung dịch từ các phân tử hoạt động bề mặt (surfactants) hoặc polyme lưỡng tính (amphiphilic polymers) khi nồng độ của chúng vượt qua một ngưỡng gọi là nồng độ micelle tới hạn (Critical Micelle Concentration – CMC). Các phân tử này có một đầu ưa nước (hydrophilic) và một đuôi kỵ nước (hydrophobic). Trong môi trường nước, các đuôi kỵ nước sẽ chụm lại với nhau tạo thành một lõi kỵ nước, trong khi các đầu ưa nước hướng ra ngoài tạo thành một lớp vỏ ưa nước (Salehi et al., 2024).
Curcumin, với bản chất kỵ nước, được bao bọc hiệu quả bên trong lõi của micelle. Cấu trúc này giúp “hòa tan” curcumin trong môi trường nước, làm tăng nồng độ của nó trong dịch tiêu hóa và tạo điều kiện cho sự hấp thu. Các micelle polyme (polymeric micelles) đặc biệt được ưa chuộng vì tính ổn định cao hơn so với micelle hoạt động bề mặt thông thường. Kích thước nhỏ (thường dưới 50 nm) cũng giúp chúng dễ dàng đi qua các rào cản sinh học và tích tụ tại các khối u thông qua hiệu ứng tăng tính thấm và lưu giữ (Enhanced Permeability and Retention – EPR) (Anand et al., 2011).
3.4. Các hệ thống khác
Ngoài ba hệ thống chính kể trên, các nhà khoa học còn phát triển nhiều DDS tiên tiến khác. Một ví dụ đáng chú ý là exosome, các túi ngoại bào có kích thước nano do chính tế bào trong cơ thể tiết ra. Một nghiên cứu đã chứng minh rằng khi curcumin được bao gói trong exosome, hoạt tính chống viêm của nó được tăng cường đáng kể, cho thấy tiềm năng của việc sử dụng các hệ vận chuyển sinh học tự nhiên (Sun et al., 2010). Các hệ thống khác như tiểu phân nano rắn lipid (Solid Lipid Nanoparticles – SLN), nanoemulsion, và dendrimer cũng đang được tích cực nghiên cứu để tối ưu hóa việc dẫn truyền curcumin (Gera et al., 2014; Rahimi et al., 2020).
4. Bảng so sánh các Hệ thống Dẫn truyền Nano
Để cung cấp một cái nhìn tổng quan và trực diện, bảng dưới đây so sánh các ưu và nhược điểm chính của ba hệ thống dẫn truyền nano curcumin phổ biến nhất.
BẢNG 1: SO SÁNH ĐẶC TÍNH KỸ THUẬT CỦA 3 HỆ DẪN TRUYỀN [3, 4, 6]
| Đặc điểm kỹ thuật | Liposome | Polymeric Nanoparticles | Polymeric Micelles |
| Kích thước hạt trung bình | 100 – 400 nm | 50 – 200 nm | 10 – 100 nm (Nhỏ nhất) |
| Độ tan trong nước | Trung bình (Dạng huyền phù) | Trung bình | Rất cao (Dung dịch trong) |
| Độ ổn định (Stability) | Thấp (Dễ bị oxy hóa/kết tụ) | Cao (Bền vững) | Cao |
| Khả năng tải thuốc | Thấp (< 10%) | Trung bình | Cao |
| Cơ chế hấp thu | Dung hợp màng tế bào | Thực bào (Endocytosis) | Khuếch tán thụ động & Thực bào |
4. Xu hướng mới : Công nghệ đích (Targeted Delivery)
Không dừng lại ở việc tăng độ tan, các nghiên cứu năm 2024 đang hướng tới việc gắn các “đầu dò” lên hạt Nano. Kumar et al. (2024) đã công bố nghiên cứu về việc gắn peptide mô phỏng MSP1D1 lên bề mặt hạt Nano để hoạt chất tự tìm đến các tế bào đích cụ thể, mở ra kỷ nguyên mới cho điều trị đích bằng thảo dược [7]. Nghiên cứu của Khan et al. (2024) cũng cho thấy tiềm năng to lớn của các hệ này trong điều trị bệnh lý tim mạch [9].
5. Kết luận
Sự chuyển đổi từ curcumin dạng thô sang các công thức nano curcumin đại diện cho một bước tiến hóa vượt bậc trong khoa học bào chế. Những hạn chế cố hữu về dược động học, vốn đã kìm hãm tiềm năng lâm sàng của curcumin trong nhiều thập kỷ, giờ đây có thể được khắc phục một cách hiệu quả nhờ vào công nghệ nano. Bằng cách áp dụng các nguyên lý vật lý cơ bản như định luật Noyes-Whitney, các nhà khoa học đã thành công trong việc tăng cường độ hòa tan và khả năng hấp thu của hoạt chất này.
Các hệ thống dẫn truyền như liposome, tiểu phân nano polyme, và micelle không chỉ đóng vai trò là “phương tiện vận chuyển” giúp cải thiện sinh khả dụng, mà còn là những công cụ tinh vi cho phép giải phóng thuốc có kiểm soát và điều trị đích. Điều này mở ra những chân trời mới cho việc ứng dụng curcumin trong điều trị nhiều bệnh lý phức tạp, từ ung thư (Wang et al., 2024), bệnh tim mạch (Khan et al., 2024) đến các bệnh viêm mãn tính (Sun et al., 2010). Việc lựa chọn hệ thống DDS phù hợp phụ thuộc vào mục tiêu điều trị cụ thể, đường dùng thuốc và đặc tính của bệnh.
Tóm lại, công nghệ nano đã thực sự “mở khóa” tiềm năng của curcumin, biến nó từ một hợp chất tự nhiên hứa hẹn thành một tác nhân trị liệu mạnh mẽ và có giá trị. Sự phát triển không ngừng của các hệ thống dẫn truyền thuốc tiên tiến hứa hẹn sẽ tiếp tục tối ưu hóa hiệu quả và mở rộng phạm vi ứng dụng của curcumin trong y học hiện đại.
6. Tài liệu tham khảo
- Ali, S., et al. (2024). The Fabrication of Polymer-Based Curcumin-Loaded Formulation as a Drug Delivery System: An Updated Review from 2017 to the Present. Pharmaceutics, 16(2), 160.
- Anand, P., et al. (2011). Advanced Drug Delivery Systems of Curcumin for Cancer Chemoprevention. Cancer Prevention Research, 4(8), 1158–1171.
- Gera, M., et al. (2014). Nanotechnology-Applied Curcumin for Different Diseases Therapy. BioMed Research International, 2014, Article ID 394264.
- Khan, M. A., et al. (2024). Nanotechnology-based Drug Delivery Systems for Curcumin and Its Derivatives in the Treatment of Cardiovascular Diseases. Journal of Industrial and Engineering Chemistry, In Press.
- Kumar, A., et al. (2024). Phospholipid-based Nano Drug Delivery System of Curcumin Using MSP1D1 Mimetic Peptide. Journal of Nanoparticle Research, 26(1), Article 21.
- Rahimi, H. R., et al. (2020). Nanocurcumin: A Promising Candidate for Therapeutic Applications. Frontiers in Pharmacology, 11, 487.
- Salehi, B., et al. (2024). Innovative Delivery Systems for Curcumin: Exploring Nanosized and Conventional Carriers for Enhanced Therapeutic Potential. International Journal of Molecular Sciences, 25(10), 5130.
- Singh, A., et al. (2024). Nano-Delivery Systems for Curcumin. Preprints.org, Manuscript ID 202403.0540.
- Sun, M., et al. (2010). A Novel Nanoparticle Drug Delivery System: The Anti-inflammatory Activity of Curcumin Is Enhanced When Encapsulated in Exosomes. Molecular Therapy, 18(9), 1606–1614.
- Wang, Y., et al. (2024). Curcumin and Nanodelivery Systems: New Directions for Targeted Therapy and Diagnosis of Breast Cancer. Biomedicine & Pharmacotherapy, 178, Article 117198.
